Sirup Obat Batuk Bikin 24 Anak Meninggal, Terungkap Fakta Mengejutkan
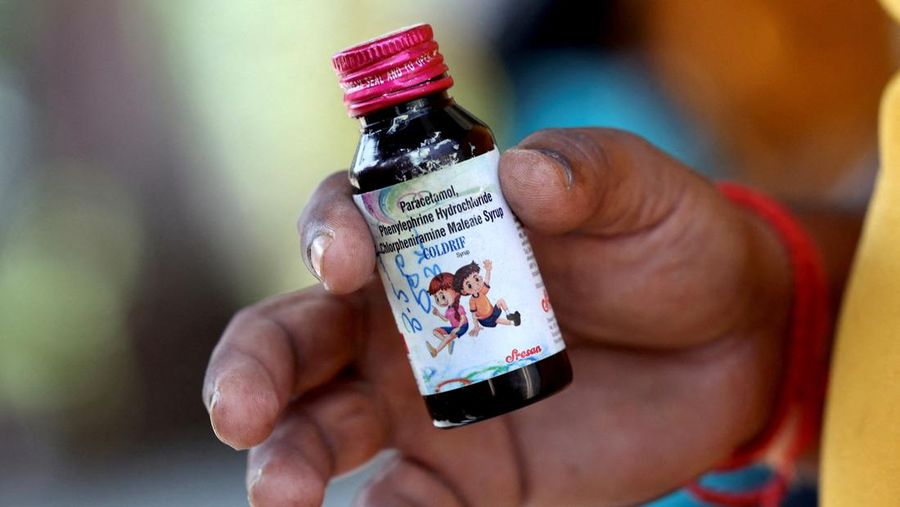
Jakarta, CNBC Indonesia - Pemerintah India tengah melakukan investigasi terkait dugaan kontaminasi sirup batuk Coldrif yang mengakibatkan sedikitnya 24 anak meninggal sejak beberapa bulan lalu. Meski kasus serupa sempat mengguncang negara itu pada 2022-2023, temuan awal penyelidikan terbaru menunjukkan potensi kelalaian dalam rantai pasokan bahan baku obat yang memicu tragedi ini.
Tiga pejabat kesehatan dan keselamatan obat Tamil Nadu yang mengetahui penyelidikan tersebut mengatakan kepada Reuters bahwa mereka tengah menelusuri kemungkinan pelarut yang digunakan dalam pembuatan satu batch sirup Coldrif telah terkontaminasi diethylene glycol (DEG), zat beracun yang kerap ditemukan dalam kasus keracunan massal terkait obat cair anak.
Penyelidikan menemukan bahwa produsen sirup, Sresan Pharmaceutical Manufacturer, membeli 50 kg propylene glycol (PG) pada 25 Maret dari distributor kimia lokal Sunrise Biotech, yang pada hari yang sama juga membeli PG tersebut dari Jinkushal Aroma, sebuah perusahaan kecil yang memproduksi campuran wewangian untuk deterjen cair dan bahan kimia sejenis.
Temuan ini tercantum dalam laporan investigasi 3 Oktober yang disusun regulator farmasi Tamil Nadu, yang salinannya diperoleh Reuters. Namun, Departemen Pengawas Obat Tamil Nadu tidak menanggapi permintaan komentar.
Para pejabat mengatakan Coldrif "sangat terkontaminasi" dengan DEG, dan penyelidikan kini menitikberatkan pada bagaimana zat industri berbahaya itu bisa masuk ke dalam pelarut PG yang digunakan sebagai basis sirup.
Kematian akibat konsumsi sirup tercemar mulai muncul pada September, memperbarui kekhawatiran global terhadap kualitas obat buatan India. Industri farmasi senilai US$50 miliar itu sebelumnya tercoreng oleh insiden yang menewaskan lebih dari 140 anak di Afrika dan Asia Tengah pada 2022-2023, yang juga terkait pelarut tercemar DEG.
Pemerintah India sebelumnya berjanji meningkatkan pengawasan mutu obat menyusul tragedi global tersebut.
Pejabat kesehatan India mengakui bahwa DEG kadang digunakan secara curang atau tidak sengaja sebagai pengganti PG yang lebih mahal-dengan risiko kerusakan ginjal akut hingga kematian pada anak.
Secara umum, pelarut PG untuk penggunaan farmasi harus dikirim dalam wadah tersegel agar terhindar dari kontaminasi. Namun Sunrise mengonfirmasi kepada Reuters bahwa mereka mengemas ulang PG tersebut tanpa segel sebelum mengirimnya ke Sresan.
Undang-Undang Obat dan Kosmetik India melarang penjualan atau penanganan bahan farmasi, termasuk PG kualitas farmasi, oleh entitas yang tidak memiliki lisensi obat.
Baik Jinkushal maupun Sunrise tidak memiliki lisensi tersebut, hal yang dikonfirmasi langsung oleh kedua distributor. Pemilik mereka menyatakan mereka tidak tahu PG yang mereka jual akan digunakan untuk memproduksi obat.
Operator Sunrise, Vipul Jain, dan pemilik Jinkushal, Jitender Vishwakarma, sama-sama mengatakan bahwa mereka tidak menangani DEG dan tidak mengetahui bagaimana pelarut tersebut bisa terkontaminasi. Reuters juga belum dapat memastikan bagaimana kontaminasi terjadi atau siapa yang bertanggung jawab.
Inspeksi regulator negara bagian setelah laporan kematian menemukan ratusan pelanggaran "kritis" dan "besar" di pabrik Sresan, termasuk penyimpanan produk dalam "kondisi tidak higienis" serta "pemalsuan data," menurut laporan 3 Oktober. Namun regulator tidak mengaitkan langsung pelanggaran tersebut dengan kematian anak-anak.
Menurut sertifikat analisis yang diberikan Jinkushal dan Sunrise kepada penyelidik, PG yang digunakan Sresan diproduksi perusahaan Korea Selatan SK picglobal. Sertifikat tersebut menampilkan tanggal produksi dan rincian komposisi kimia.
Perusahaan Korea itu mengekspor PG dalam drum 215 kg yang tersegel ke distributor India, yang kemudian menjualnya ke Jinkushal. Vishwakarma mengatakan ia memecah segel drum tersebut dan mengemas ulang PG itu di tokonya sebelum menjual sebagian kepada Sunrise.
Sunrise kemudian mengirim pelarut itu ke Sresan dalam dua kontainer tanpa segel keamanan karena pabrik obat hanya membutuhkan sebagian dari pasokan asli.
Juru bicara SK picglobal mengatakan perusahaan melarang keras pengemasan kembali atau redistribusi produknya. Ketika ditanya apakah larangan itu tertulis dalam kontrak, perusahaan mengatakan mereka telah menyampaikan kepada pelanggan dalam pertemuan bahwa mereka tidak "menjamin kualitas produk yang telah dikemas ulang atau dipisah secara sembarangan." Tidak ada rincian tambahan yang diberikan.
Empat pejabat yang mengetahui kasus ini mengatakan Sresan sebelumnya pernah dijatuhi sanksi, termasuk pendirinya yang ditahan satu hari pada 2020 dan 2022 sebelum hanya dikenai denda. Mereka tidak memberikan bukti dokumen atas sanksi tersebut.
Menteri Kesehatan Tamil Nadu mengatakan kepada anggota parlemen bulan lalu bahwa Sresan juga pernah dikenai penalti pada 2021 dan 2023 atas "pelanggaran kecil," tanpa menjelaskan lebih jauh.
Dua pejabat kesehatan negara bagian mengatakan, meski memiliki rekam jejak pelanggaran dan adanya aturan inspeksi tahunan, pabrik Sresan tidak diperiksa sejak 2023.
(luc/luc)
[Gambas:Video CNBC]